第一节 单克隆抗体基本生产技术、工艺或流程
(一)普通单克隆抗体的制备方法如下:
1、动物的选择与免疫
1)动物的选择
纯种BALB/C小鼠,较温顺,离窝的活动范围小,体弱,食量及排污较小,一般环境洁净的实验室均能饲养成活。目前开展杂交瘤技术的实验室多选用纯种BALA/C小鼠。
2)免疫方案
选择合适的免疫方案对于细胞融合杂交的成功,获得高质量的McAb至关重要。一般在融合前两个月左右根据确立免疫方案开始初次免疫,免疫方案应根据抗原的特性不同而定。
(1)可溶性抗原免疫原性较弱,一般要加佐剂,半抗原应先制备免疫原,再加佐剂。常用佐剂:福氏完全佐剂、福氏不完全佐剂。
初次免疫抗原1~50μg加福氏完全佐剂皮下多点注射或脾内注射(一般0.8~1ml,0.2ml/点)。
↓3周后,第二次免疫剂量同上,加福氏不完全佐剂皮下或ip(腹腔内注射)(ip剂量不宜超过0.5ml)。
↓3周后,第三次免疫剂量同一,不加佐剂,ip(5~7天后采血测其效价)。
↓2~3周,加强免疫,剂量50~500μg为宜,ip或iv(静脉内注射)。
↓3天后,取脾融合。
目前,用于可溶性抗原(特别是一些弱抗原)的免疫方案也不断有所更新,如:①将可溶性抗原颗粒化或固相化,一方面增强了抗原的免疫原性,另一方面可降低抗原的使用量。②改变抗原注入的途径,基础免疫可直接采用脾内注射。③使用细胞因子作为佐剂,提高机体的免疫应答水平,增强免疫细胞对抗原的反应性。
(2)颗粒抗原免疫性强,不加佐剂就可获得很好的免疫效果。以细胞性抗原为例,免疫时要求抗原量为1~2×107个细胞。
初次免疫1×107/0.5mlip。
↓2~3周后,第二次免疫1×107/0.5mlip。
↓3周后,加强免疫(融合前三天)1×107/0.5mlip或iv。
↓取脾融合。
2、细胞融合
1)细胞融合前准备
(1)骨髓瘤细胞系的选择:
骨髓瘤细胞应和免疫动物属于同一品系,这样杂交融合率高,也便于接种杂交瘤在同一品系小鼠腹腔内产生大量McAb。
常用的骨髓瘤细胞系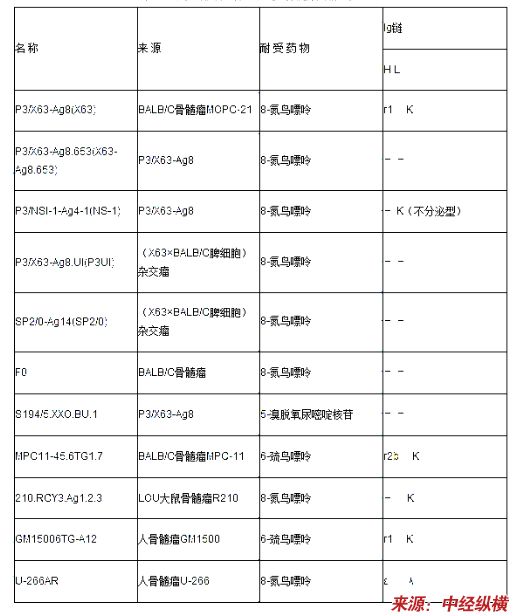
骨髓瘤细胞的培养可用一般的培养液,如RPMI1640,DMEM培养基。小牛血清的浓度一般在10%~20%,细胞浓度以104~5×105/ml为宜,最大浓度不得超过106/ml。当细胞处于对数生长的中期时,可按1:3~1:10的比例传代。每3~5天传代一次。细胞在传代过程中,部分细胞可能有返祖现象,应定期用8-氮鸟嘌呤进行处理,使生存的细胞对HAT呈均一的敏感性。
(2)饲养细胞:在组织培养中,单个或少数分散的细胞不易生长繁殖,若加入其它活细胞,则可促进这些细胞生长繁殖,所加入的这种细胞数被称为饲养细胞。在制备McAb的过程中,许多环节需要加饲养细胞,如在杂交瘤细胞筛选、克隆化和扩大培养过程中,加入饲养细胞是十分必要的。常用的饲养细胞有:小鼠腹腔巨噬细胞(较为常用)、小鼠脾脏细胞或胸腺细胞。也有人用小鼠成纤维细胞系3T3经放射线照射后作为饲养细胞。饲养细胞的量为一般为2×104或105细胞/孔。
2)细胞融合的步骤
(1)制备饲养细胞层:一般选用小鼠腹腔巨噬细胞。
与免疫小鼠相同品系的小鼠,常用BALB/C小鼠,6~10周
↓拉颈处死,浸泡在75%酒精内,3~5min。
↓用无菌剪刀剪开皮肤,暴露腹膜。
↓用无菌注射器注入5~6ml预冷的培养液(严禁刺破肠管)。
↓反复冲洗,吸出冲洗液。
↓冲洗液放入10ml离心管,1200rpm/分离5~6min。
↓用20%小牛血清(NCS)或胎牛血清(FCS)的培养液混悬,调整细胞数至1×105/ml。
↓加入96孔板,100μl/孔。
↓放入37℃CO2孵箱培养。
(2)制备免疫脾细胞
最后一次加强免疫3天后小鼠拉颈处死。
↓无菌取脾脏,培养液洗一次。
↓脾脏研碎,过不锈钢筛网。
↓离心,细胞用培养液洗2次。
↓计数。
↓取108脾淋巴细胞悬液备用。
(3)制备骨髓瘤细胞
取对数生长骨髓瘤细胞离心。
↓用无血清培养液洗2次。
↓计数,取得×107细胞备用。
(4)融合
①将骨髓瘤细胞与脾细胞按1:10或1:5的比例混合在一起,在50ml离心管中用无血清不完全培养液洗1次,离心,1200rpm,8min;弃上清,用吸管吸净残留液体,以免影响聚乙二醇(PEG)浓度。轻轻弹击离心管底,使细胞沉淀略松动。
②90s内加入37℃预温的1ml45%PEG(分子量4000)溶液,边加边轻微摇动。37℃水浴作用90s。
③加37℃预温的不完全培养液以终止PEG作用,每隔2min分别加入1ml、2ml、3ml、4ml、5ml和6ml。
④离心,800rpm,6min。
⑤充上清,用含20%小牛血清HAT选择培养液重悬。
⑥将上述细胞,加到已有饲养细胞层的96孔板内,每孔加100μl。一般一个免疫脾脏可接种4块96孔板。
⑦将培养板置37℃、5%CO2培养箱中培养。
3、选择杂交瘤细胞及抗体检测
1)HAT选择杂交瘤细胞
脾细胞和骨髓瘤细胞经PEG处理后,形成多种细胞的混合体,只有脾细胞与骨髓细胞形成的杂交瘤细胞才有意义。在HAT选择培养液中培养时,由于骨髓瘤细胞缺乏胸苷激酶或次黄嘌呤鸟嘌呤核糖转移酶,故不能生长繁殖,而杂交瘤细胞具有上述两种酶,在HAT选择培养液可以生长繁殖。
在用HAT选择培养1~2天内,将有大量瘤细胞死亡,3~4天后瘤细胞消失,杂交细胞形成小集落,HAT选择培养液维持7~10天后应换用HT培养液,再维持2周,改用一般培养液。在上述选择培养期间,杂交瘤细胞布满孔底1/10面积时,即可开始检测特异性抗体,筛选出所需要的杂交瘤细胞系。在选择培养期间,一般每2~3天换一半培养液。
2)抗体的检测
检测抗体的方法应根据抗原的性质、抗体的类型不同,选择不同的筛选方法,一般以快速、简便、特异、敏感的方法为原则。
常用的方法有:(1)放射免疫测定(RIA)可用于可溶性抗原、细胞McAb的检测。(2)酶联免疫吸附试验(ELISA)可用于可溶性抗原、细胞和病毒等McAb的检测。(3)免疫荧光试验适合于细胞表面抗原的McAb的检测。(4)其它如间接血凝试验、细胞毒性试验、旋转粘附双层吸附试验等。
4、杂交瘤的克隆化
杂交瘤克隆化一般是指将抗体阳性孔进行克隆化。因为经过HAT筛选后的杂交瘤克隆不能保证一个孔内只有一个克隆。在实际工作中,可能会有数个甚至更多的克隆,可能包括抗体分泌细胞、抗体非分泌细胞、所需要的抗体(特异性抗体)分泌细胞和其它无关抗体的分泌细胞。要想将这些细胞彼此分开就需要克隆化。克隆化的原则是,对于检测抗体阳性的杂交克隆尽早进行克隆化,否则抗体分泌的细胞会被抗体非分泌的细胞所抑制,因为抗体非分泌细胞的生长速度比抗体分泌的细胞生长速度快,二者竞争的结果会使抗体分泌的细胞丢失。即使克隆化过的杂交瘤细胞也需要定期的再克隆,以防止杂交瘤细胞的突变或染色体丢失,从而丧失产生抗体的能力。
克隆化的方法很多,最常用的是有限稀释法和软琼脂平板法。
1)有限稀释法克隆
(1)克隆前1天制备饲养细胞层(同细胞融合)。
(2)将要克隆的杂交瘤细胞从培养孔内轻轻吹干,计数。
(3)调整细胞为3~10个细胞/ml。
(4)取头天准备的饲养细胞层的细胞培养板,每孔加入稀释细胞100μl。孵育于37℃、5%CO2孵箱中。
(5)在第7天换液,以后每2~3天换液1次。
(6)8~9天可见细胞克隆形成,及时检测抗体活性。
(7)将阳性孔的细胞移至24孔板中扩大培养。
(8)每个克隆应尽快冻存。
2)软琼脂培养法克隆
(1)软琼脂的配制:含有20%NCS(小牛血清)的2倍浓缩的RPMI1640。
①1%琼脂水溶液:高压灭菌,42℃预热。
②0.5%琼脂:由1份1%琼脂加1份含20%小牛血清的2倍浓缩的RPMI1640配制而成。置42℃保温。
(2)用上述0.5%琼脂液(含有饲养细胞)15ml倾注于直径为9cm的平皿中,在室温中待凝固后作为基底层备用。
(3)按100/ml,500/ml或5000/ml等浓度配制需克隆的细胞悬液。
(4)1ml0.5%琼脂液(42℃预热)在室温中分别与1ml不同浓度的细胞悬液相混合。
(5)混匀后立倾注于琼脂基底层上,在室温中10min,使其凝固,孵育于37℃、5%CO2孵箱中。
(6)4~5天后即可见针尖大小白色克隆,7~10天后,直接移种至含饲养细胞的24孔中进行培养。
(7)检测抗体,扩大培养,必要是地再克隆化。
5、杂交瘤细胞的冻存与复苏
1)杂交瘤细胞的冻存
及时冻存原始孔的杂交瘤细胞每次克隆化得到的亚克隆细胞是十分重要的。因为在没有建立一个稳定分泌抗体的细胞系的时候,细胞的培养过程中随时可能发生细胞的污染、分泌抗体能力的丧失等等。如果没有原始细胞的冻存,则可因上述意外而前功尽弃。
杂交瘤细胞的冻存方法同其他细胞系的冻存方法一样,原则上细胞应在每支安瓿含1×106以上,但对原始孔的杂交瘤细胞可以因培养环境不同而改变,在24孔培养板中培养,当长满孔底时,一孔就可以装一支安瓿冻存。
细胞冻存液:50%小牛血清;40%不完全培养液;10%DMSO(二甲基亚砜)。
冻存液最好预冷,操作动作轻柔、迅速。冻存时从室温可立即降至0℃后放入-70℃超低温冰箱,次日转入液氮中。也可用细胞冻存装置进行冻存。冻存细胞要定期复苏,检查细胞的活性和分泌抗体的稳定性,在液氮中细胞可保存数年或更长时间。
2)细胞复苏方法
将玻璃安瓿自液氮中小心取出,放37℃水浴中,在1min内使冻存的细胞解冻,将细胞用完全培养液洗涤两次,然后移入头天已制备好的饲养层细胞的培养瓶内,置37℃、5%CO2孵箱中培养,当细胞形成集落时,检测抗体活性。
6、单克隆抗体的大量生产
大量生产单克隆抗体的方法主要有两种:
1)体外使用旋转培养管大量培养杂交瘤细胞,从一清液中获取单克隆抗体。但此方法产量低,一般培养液内抗体含量为10~60μg/ml,如果大量生产,费用较高。
2)体内接种杂交瘤细胞,制备腹水或血清。
(1)实体瘤法:对数生长期的杂交瘤细胞按1~3×107/ml接种于小鼠背部皮下,每处注射0.2ml,共2~4点。待肿瘤达到一定大小后(一般10~20天)则可采血,从血清中获得单克隆抗体的含量可达到1~10mg/ml。但采血量有限。
(2)腹水的制备:常规是先腹腔注射0.5mlPristane(降植烷)或液体石蜡于BALB/C鼠,1~2周后腹腔注射1×106个杂交瘤细胞,接种细胞7~10天后可产生腹水,密切观察动物的健康状况与腹水征象,待腹水尽可能多,而小鼠频于死亡之前,处死小鼠,用滴管将腹水吸入试管中,一般一只小鼠可获5~10ml腹水。也可用注射器抽提腹水,可反复收集数次。腹水中单克隆抗体含量可达到5~10mg/ml,这是目前最常用的方法,还可将腹水中细胞冻存起来,复苏后转种小鼠腹腔则产生腹水块、量多。
7、单克隆抗体的鉴定
对制备的McAb进行系统的鉴定是十分必要的,应做下述几个方面的鉴定:
1)抗体特异性的鉴定
除用免疫原(抗原)进行抗体的检测外,还应该用与其抗原成分相关的其它抗原进行交叉试验,方法可用ELISA、IFA法。例如:①制备抗黑色素瘤细胞的McAb,除用黑色素瘤细胞反应外,还应该用其它脏器的肿瘤细胞和正常细胞进行交叉反应,以便挑选肿瘤特异性或肿瘤相关抗原的单克隆抗体。②制备抗重组的细胞因子的单克隆抗体,应首先考虑是否与表达菌株的蛋白有交叉反应,其次是与其它细胞因子间有无交叉。
2)McAb的Ig类与亚类的鉴定
一般在用酶标或荧光素标记的第二抗体进行筛选时已经基本上确定了抗体的Ig类型。如果用的是酶标或荧光素标记的兔抗鼠IgG或IgM,则检测出来的抗体一般是IgG类或IgM类。至于亚类则需要用标准抗亚类血清系统作双扩或夹心ELISA来确定。在作双扩试验时,如加入适量的PEG(3%),更有利于沉淀线的形成。
3)McAb中和活性的鉴定
用动物或细胞的保护实验来确定McAb的生物学活性。例如,如果确定抗病毒McAb的中和活性,则可用抗体和病毒同时接种于易感的动物或敏感的细胞,来观察动物或细胞是否得到抗体的保护。
4)McAb识别抗原表位的鉴定
用竞争结合试验,测相加指数的方法,测定McAb所识别抗原位点,来确定McAb的识别的表位是否相同。
5)McAb亲合力的鉴定
用ELISA或RIA竞争结合试验来确定McAb与相应抗原结合的亲合力。
(二)制备人单抗的途径
目前,制备人单抗的途径主要有以下5种:
1、人-鼠杂交瘤技术;
2、人-人杂交瘤技术;
3、EB病毒转化技术;
4、EB病毒转化-杂交瘤技术;
5、DNA重组技术。
人源单抗的制备具有建株困难、Ig产量低、稳定性和亲和力差等难点,且一直缺乏有效的解决办法。近年来基因工程技术的发展,为鼠一人嵌合单抗的制备开创了新的途径。利用淋巴细胞杂交瘤技术建立分体特异性单抗杂交瘤细胞系,从中提取已重排的编码功能性IgDNA基因组(组建DNA文库)或成熟的IgH/L链mRNA片段(组建cDNA文库及制备探针),从而获得编码特异性单机的V区基因;利用DNA重组技术,将此来源于小鼠特异性IgH、L链的C区基因组重组,构建鼠-人嵌合的Ig重组基因;然后将此重组嵌合的Ig基因导入真核表达质粒(多为pSVZ-ypt和pSVZ-neo);经磷酸钙沉淀技术、原生质体融合技术或电穿孔导人技术,将此赝位转染哺乳动物非分泌型骨髓瘤细胞,经选择性培养基培养,从中筛选分泌完鳖功能性鼠-人嵌合单抗。此单抗临床用于人体内诊断和治疗时,不但具有原鼠源单抗的特异性、亲和力和细胞毒性,同时还有优于鼠源单抗的介导补体,细胞对靶抗原的杀伤作用,而且不会引起过敏反应或干扰治疗效果。从而为临床体内诊断、治疗恶性肿瘤和病毒性疾病提供了一种新型的免疫治疗制剂。
现DNA重组鼠一人嵌合单抗已有下列4种:
(1)小鼠F(ab)2-人FC段的嵌合抗体;(2)小鼠-人嵌合的Fab抗体;(3)小鼠-人嵌合单抗Fab片段-酶的重组抗体;(4)鼠抗体超变区(CDR)植入人单抗的嵌合体,即在人单抗可变区H、L链上分别植入3-4条鼠抗体的CDR区带。
由于鼠-人嵌合单抗中鼠抗体蛋白成分减少,从而增加了临床反复使用单抗治疗的可能性。
第二节 单克隆抗体新技术研发、应用情况
治疗性单克隆抗体的快速发展在人类以肿瘤为主的多种疾病的治疗方面发挥至关重要的作用。为了降低鼠源抗体引起的超敏反应,治疗性单克隆抗体已由改型抗体,人源化抗体发展到全人抗体。随着生物技术的不断发展,相信人源化单克隆抗体的前景会越来越广泛。
第三节 单克隆抗体国外技术发展现状
近年来,随着Symphoge公司的Symplex和Sympress等技术的发展,以及由此而生产、用于治疗原发性血小板减少性紫癜(ITP)和新生儿溶血症(HDN)的多克隆抗体药物Sym001(anti-RhD)进入Ⅱ期临床试验,重组多克隆抗体药物 研究 也呈现出良好的发展态势。
2011年3月1日英国一 研究 小组在最近一期出版的《免疫学杂志》上发表论文称,他们开发出一种单克隆抗体,经实验模型验证,该抗体与干扰素结合使用,可有效对抗肺结核感染。 研究 人员认为,这一成果有助于科学家开发出新的结核病治疗手段。该 研究 小组由英国邓迪大学、伦敦国王大学以及伦敦大学圣乔治学院的 研究 人员组成。他们开发的这种单克隆抗体是一种A类免疫球蛋白(lgA),属于同质性抗体,可识别结核杆菌。它通过绑定结核杆菌细菌,触发人体免疫反应,从而防止该细菌生长蔓延。论文称,尽管单克隆抗体已被广泛用于癌症和炎症性疾病的治疗,但这还是第一次 研究 表明,它可以用来治疗结核病。
第四节 单克隆抗体技术开发热点、难点 分析
在合作研发、生产单抗药物的过程中,有两大技术难点,一是抗体人源化技术,二是哺乳动物细胞规模化培养。
由于抗体细胞是在小鼠身上培养并提取,因此早期单抗药物都是鼠源性单抗,这样的药物特异性很强,但却也常常引起人体的免疫反应,毒副作用明显。因此,第二代嵌合性单抗药物便对小鼠抗体表面氨基酸残基进行人源化改造,其人源化程度达到70%左右。第三代人源化单抗使人源化程度达到95%左右,使之更加接近于人体自身的抗体。如今外国在临床上已出现第四代全人源化技术。
人源化技术的难点在于它需要大量的学科集成,非常复杂,任何氨基酸改变都会影响蛋白质结构、活性,这方面没有太多规范可以遵循,因此需要大量的实践和探索。这是单抗药物研发的核心技术。”他同时指出,从安全性、疗效与价格来看,并综合考虑成本投入、产出时间、技术水平等因素,当前做到人源化抗体已基本可以满足国内市场。
第五节 单克隆抗体未来技术发展趋势
当前国内外主要以嵌合体、人源化抗体为主,未来将主要集中于淘汰鼠源性及嵌合抗体,转向人源化,尤其是应该向完全人源化抗体、基因工程抗体等一系列技术趋势发展。
同时在未来一段内,抗肿瘤产品仍将在单克隆抗体这一市场中占主导地位,但在抗关节炎药、免疫系统疾病和炎症性疾病治疗药的技术上也会有所突破,并将出现强劲增长。
免责申明:本文仅为中经纵横 市场 研究 观点,不代表其他任何投资依据或执行标准等相关行为。如有其他问题,敬请来电垂询:4008099707。特此说明。




