第一节 产品定义、性能及应用特点
一、产品定义
储氢材料是一类能可逆地吸收和释放氢气的材料。某些过渡金属、合金或金属互化物在一定的温度和压力条件下能大量吸收或释放氢气,可作为储氢材料。最有希望获实际应用的是LaNi5和FeTi,形成固体氢化物LaNi5H6和FeTiH1.95后,单位体积的氢储量可达88和101.2千克/米3,高于液氢的70.6千克/米3。一般是本身重量的1.3%~1.7%,相当于本身体积的1000倍以上(金属钯Pd吸氢能高达本身体积2800倍,但因物稀价昂,一般只用于制超纯氢而不用作储氢材料)。因储氢材料在吸氢和放氢时有热效应和能量交换,这类材料也能储存热能或其他能量,所以也称为储能材料或能量转换材料。
二、分类、性能
储氢材料按氢结合的方式可分为化学储氢(如储氢合金、配位氢化物、氨基化合物、有机液体等)和物理储氢(如碳基材料、金属有机框架材料(MOF)等).
1、化学吸附
目前应用最多的储氢材料是合金。在二元金属氢化物中,两个氢原子的最小距离仅为0.21nm,因此合金往往能提供很高的单位体积储氢容量。然而,由于金属原子的质量相对比较大,合金的单位重量储氢容量一般都很低。为此,人们又开发了轻金属的复合氢化物,如硼氢化物、铝氢化物等。这类物质中氢的质量分数都很高,很有发展潜力。
化学吸附材料中最有名的要数LaNi5,它是镍氢电池的负极材料。
1)金属氢化物及合金
许多金属和合金都有可逆吸收大量氢气的能力。氢气与金属或合金反应形成氢化物的热力学可以用压力-组成等温线来描述。主体金属先以固溶体形式溶解一些氢(α相)。当压力及金属中原子氢的浓度增大时,局部氢原子之间的相互作用变得显著,此时就能观察到氢化物β相的成核与生长。两相共存时,等温线出现一段平台期,其长度决定了在较小压力变化下有多少H2能够被可逆地储存。在纯β相中,随浓度增加,H2的压力陡然上升。在更高的H2压力下,会有另外的平台期和氢化物相形成。两相共存区域终止于临界温度(TC),在此温度之上相变没有平台期。
LaNi5的数据
由van’t Hoff等温式:,平台压力或平衡压力peq强烈地依赖于温度,而且与焓变和熵变分别相关。熵变主要是由于气态氢分子数的变化而产生,目前 研究 中的所有金属-氢系统,其吸氢熵变都大约为130J K-1 mol-1(脱氢熵变)。而焓变项表征了金属-氢键的稳定性。要在300K使平衡压力达到1bar,ΔH应达到19.6kJ molH-1(脱氢焓变)。金属氢化物体系的工作温度由热力学平衡压力和整个反应的动力学决定。
氢在填入主体金属的晶格后以原子形式存在,如下图所示。在吸附氢气过程中,晶格会有所增大,并部分失掉其高度对称性。未膨胀的α相及各向异性膨胀的β相共存能导致晶格缺陷和内部变形,并使主体金属变得极其脆弱而最终碎裂。氢原子在它们的平衡位置附近振动,进行短距离的移动和长距离的扩散。
主体金属填入氢后晶格
金属氢化物及合金一般在吸氢时显为放热反应,脱氢时显为吸热反应。如LaNi5的吸放氢反应:

压力稍高而温度低时此材料可以吸收氢,而当压力降低或温度升高时氢又可释放出来,这就实现了反复吸放氢的过程。但对放氢过程(吸热反应)来说,为了使反应进行,必须补充必要的能量,否则反应会因温度降低而停止。这是一个亟待解决的问题。
许多金属元素都能形成氢化物,如PdH0.6,稀土REH2、REH3和MgH2,却没有一种能符合汽车储氢的要求(1-10bar,0-100℃,焓变介于15和24 kJ molH-1之间)。实际上,单一金属的氢化物因其高的热力学稳定性而很难在储氢方面有所建树。金属互化物氢气吸附的发现给了人们希望,并刺激了世界范围内对该领域的 研究 。
(1)LaNi5、过渡金属储氢合金
合金LaNi5表现出许多优秀的特性,比如其吸附快而可逆、室温下平台温度为几bar以及良好的循环寿命。2bar时LaNi5H6.5的单位体积储氢密度(晶体)等于1800bar下气态分子氢的密度;有利的是,所有的氢都可在2bar下脱附。实际应用中储氢密度因为部分LaNi5粉末的聚集而有所减少,但仍高于液态氢的密度。金属互化物允许人们安全地操作氢燃料。但是,由于镧和镍都是较重的元素,LaNi5H6.5中氢的质量分数只有不到2%。该物质很适合可充电金属氢化物电极的电化学储氢,容量可达330mA h g-1。每年生产和销售的AB5型金属氢化物电池超过十亿个。
然而,这对于车用氢燃料来说还是远远不够的。我们至少需要达到4-5 wt.%,以接近DOE的目标。氢质量密度低是所有已知金属氢化物在室温附近工作时的普遍缺陷。当然,我们了解到,许多金属互化物能够形成质量分数高达9%(如Li3Be2H7)以及每金属原子多达4.5个H原子(如BaReH9)的氢化物,但是他们在所要求的温度和压力范围内可逆性很差。
此外,储氢合金还存在易中毒的缺点,这会影响它的使用寿命。
目前开发出的类似的过渡金属储氢合金还有钛-铁系合金(如TiFe)和钛-锆系合金等。
(2)镁系储氢合金
要实现更高的储氢质量密度,只能靠钙、镁这样的轻金属。镁系储氢合金是一个大的 研究 方向:Mg2Ni可以形成三元氢化物Mg2NiH4,其中含有氢3.6 wt.%,单位体积容量高达150kgH2 m-3。氢化物的形成很迅速,主要是由于镍的存在催化了分子氢的解离,但相较于单质镁,合金在热力学上并没有大的改进:平衡氢压为1bar时工作温度为280℃(金属镁300℃),这是它存在的最大问题。合金Mg2Cu、Mg17La2、MgAl以及其他一些已知的Mg的金属互化物及合金,很容易与氢反应并分解为MgH2和其他化合物。如Mg2Cu+H2分解为MgH2+MgCu2,且反应在高温下可逆。镁不能与铁形成二元的金属互化物,但在氢存在下合成稳定得多的三元氢化物Mg2FeH6却是可能的,它含有5.5 wt.%的H。
使用复合材料,把两种成分的优点结合起来克服其缺点,也是一种改善材料性能的途径。例如,与石墨一起球磨过或掺杂了氢化物的金属镁吸放氢速率都较快。显而易见,复合材料的储氢容量介于各成分之间。
另外,通过球磨方法制备出的纳米颗粒合金往往能表现出更好的性能。比如球磨法制备的LaNi5,其氢化反应的速率有一定程度的加快。
球磨法制备LaNi5
2)复合氢化物
复合氢化物是一类无机类盐化合物,其中阴离子为[BH4]-、[AlH4]-,轻金属阳离子(Li+、Na+等)存在以保持电中性。硼和铝的复合氢化物M[BH4]以及M[AlH4]或许是迄今为止最有前途的储氢材料,它们在可逆吸氢方面表现得很出色,基本达到了美国能源局的目标。其纯物质在热力学上相当稳定,仅在高温时分解,温度甚至超过了熔点。他们最主要的优势在于,材料中氢的质量百分比很高,如LiBH4中含氢量可以高达18 wt.%。它们与前述金属氢化物的区别在于,氢在开始时是存在于化合物中的,并非通过化学吸附进入体系;它们是离子化合物,释放氢的机理与合金不同。更重要的是,人们在对该类物质的 研究 中发现,将物质颗粒缩小到纳米尺度以及掺入杂质粒子都能显著改进材料的性能,这为今后的研发工作指引了方向。
(1)铝氢化物
铝氢化物被认为是潜在的储氢材料,其中含有配离子[AlH4]-或[AlH6]3-。若干种含有轻阳离子的铝氢化物已被作为储氢材料 研究 。其中NaAlH4被 研究 得最多,也被认为是最有前途的一种,因为它氢含量高、热力学性质优良。NaAlH4在高温下的热分解分为两步,最终得到NaH、Al和H2。456K下纯NaAlH4晶体开始熔化,513K附近熔盐分解生成Na3AlH6和金属铝,573K以上Na3AlH6分解产生两固相NaH、Al的混合物。理论上第一步可以产生3.7 wt.%的H2,第二步产生的H2提高到5.5 wt.%:
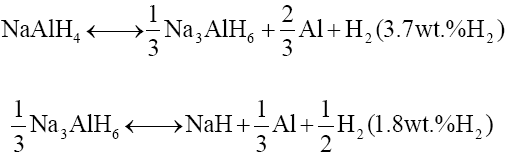
两步分解都是可逆的。NaH分解为Na和氢则需要更高的温度(723K以上),不适合实际应用。
材料经过球磨之后,分解的温度降低至NaAlH4的熔点以下,这可能是因为反应活化能的降低。目前尚没有对该现象机理的 研究 。颗粒的大小对于这种材料的动力学性能影响很大,纳米颗粒级NaAlH4的储氢性能远远好于未经特殊处理的NaAlH4。
另一个对性能有较大影响的因素是杂质。在NaAlH4中掺入某些杂质可以有效降低分解温度。Bogdanovic等人的 研究 表明,当掺入其他金属阳离子如Ti3+、Ti4+、Zr4+、Fe3+时,分解反应的前两步加快,分解温度也显著下降。X射线衍射 分析 (XRD)和固态NMR光谱表明,产物中比较多的相有NaAlH4、Na3AlH6、Al和NaH。其中也发现了一些未认定的相的痕迹,其中的一种被猜测是Al-Ti合金。最近Bogdanovic等人又报道,在铝氢化钠中掺杂TiN纳米微粒可以明显地降低分解所需温度以及实际应用中氢化所需的时间,放出的氢气量还相当地接近理论极限值。
(2)LiBH4
LiBH4的含氢量高达18 wt.%。 研究 人员通过热 分析 猜测其分解的机理。热 分析 表明LiBH4主要有三个分解峰。第一个峰出现在100℃附近,伴随着从正交到多晶的结构转变和少量氢(0.3 wt.%)的逸出,不太明显。270℃可观察到物质的熔化,没有氢逸出。在320℃第一个显著的脱氢峰出现,放出1.0 wt.%的氢。第二个显著的峰在400℃附近开始,在500℃达到最大。到600℃时,放出氢气的总量是9 wt.%,精确地等于开始时化合物含氢量的一半,这时的产物有形式上的组成“LiBH2”。


将LiBH4和SiO2粉混合在一起(重量比25:75)能降低脱氢的温度,释放出氢气的量在400℃以下就可达到9 wt.%,在更高温度则能达到13.5 wt.%的最大值:

在其热分解图谱中也发现三个脱氢峰。SiO2粉催化LiBH4的分解反应,并降低全部三个脱氢峰的温度。在分解产物中共有4.5 wt.%的氢以LiH形式存在。图表示了加SiO2和未加SiO2时LiBH4的热分解曲线。
加SiO2和未加SiO2时LiBH4的热分解曲线
(3)NaBH4
硼氢化物的水溶液能以可控的方式安全地释放气态氢,它代表了固相体系的另一种利用方式。水溶液中硼氢化物的自发水解一般可以通过加入NaOH加以抑制,这些溶液在催化剂如Ru或Ni的存在下可以有效地释放出氢气。理论上NaBH4水溶液能产生7.3 wt.%的氢气。在40℃,10 wt.% NaOH溶液中释氢量最高能达到6.5 wt.%。从碱性NaBH4水溶液中产生氢气有很多吸引人的优点,比如:
NaBH4溶液可在空气中稳定达数月;
氢气的产生仅在指定的催化剂存在下发生,甚至在0℃也可以进行;
气流中的除H2以外其他物质是水蒸气及其他可回收的产物;
可以对氢气的产生速率方便地加以控制;
单位体积和单位重量的储氢容量很高。
以上各点说明,从商业观点来看,硼氢化物水溶液是一种很有前途的高密度氢源。因其具有比气罐中的压缩氢气高得多的单位体积氢密度,虽然硼氢化钠的产氢过程不可逆并且产生含硼废物,但它对于一次性使用来说还是上佳的选择。
2)物理吸附
物理吸附主要是靠材料表面与分子氢之间的范德华力完成的,不发生氢分子的解离。因为氢分子只含两个电子且是最小的分子之一,很难被极化,所以材料与氢分子的相互作用很弱,在室温及更高温度下氢气很容易脱附,但是,如果材料有很大的比表面,还是可以表现出较好储氢性能的。为增大其表面积,人们倾向于将其颗粒缩小至纳米尺度。利用微孔材料包藏氢分子则是另一种储氢方法,正在 研究 之中。
该 研究 领域中比较重要的物质有纳米材料、沸石、金属有机骨架化合物等。这些化合物很有潜力,但到目前为止它们的性能与我们设定的目标仍相差甚远,进入应用领域尚需时日。
(1) 纳米材料
对纳米材料的 研究 开始于20世纪90年代,发展至今不过十几年的时间,仍缺乏系统的理论支持。纳米材料储氢中被 研究 最多的是纳米碳材料,它主要包括纳米石墨纤维(GNF)、多壁碳纳米管(MWNT)、单壁碳纳米管(SWNT)。
1998年曾有人报道,他们用纳米石墨纤维实现了高达67 wt.%的储氢容量。然而这种超乎寻常的储氢能力并不为理论所支持,如此高的数值在其后的实验中再也没有出现过,因此该报道的真实性受到了很大质疑。
纳米碳材料具有很高的比表面,与氢气接触的界面很大。其中,纳米石墨碳的比表面与其储氢容量几乎成正比关系:在77K(液氮温度)下,比表面每增大1000m2g-1,储氢容量就增加1.5 wt.%,如图(圆点表示碳纳米管样品,三角形表示其它纳米碳样品)。用球磨等方法对其进行处理可以提高其性能,如在1MPa氢气氛中球磨80h的纳米石墨可以吸附7.4 wt.%的氢,600K以上有八成的氢解吸附。碳纳米管具有空腔,吸附的氢分子既可以处于管外壁,也可以进入空腔,因此碳纳米管可以表现更佳的性能,其吸附氢的密度与-253℃下液态氢的密度差不多。实验证明,碳纳米管的储氢能力与管径相关。
纳米石墨碳的比表面与其储氢容量成正比
然而,碳纳米管储氢性能的 研究 中有很多的争论出现,不同文献的数据间有一定差别。这些争论在很大程度上是由 研究 所使用的碳材料性质不均引起的,碳纳米管有的封闭、有的开口;有的是单壁、有的是多壁,而且半径和长度也各不相同。这给 研究 造成了一定障碍。
研究 不同特征的纳米碳材料与氢分子之间的相互作用是一件有趣而富有挑战性的工作。但就目前的 研究 来看,在它们中间能否产生可以付诸应用的储氢材料仍是一个很大的问号。
除了纳米碳,还有一些无碳纳米材料也在 研究 之中,比如氮化硼纳米管(图7)、二硫化钛纳米管以及二硫化钼纳米管等。其中某些材料对氢的吸附既包含物理作用也包含化学作用。
(2) 沸石
沸石对气体的可逆吸附广为人知,但很少有人关注它在储氢方面的应用。NaA或NaX型沸石每克含3.58×1020个沸石笼,方钠石则含1.41×1021个。不同材料每笼包含H2分子数在0.1和0.25之间。在573K,氢压10MPa条件下,方钠石储氢能力最强,达到9.2 cm3/g(0.082 wt.%),此数据说明被H2占据的笼只有1/4或1/5,原因未知。如果每个笼被一个氢气分子占据,则方钠石的理论最大储氢容量为54 cm3/g(0.48 wt.%)。
如上所述,沸石在常温附近的储氢容量实在少得可怜(0.082 wt.%),距离我们6.5 wt.%的目标相差甚远,而且潜力甚微。沸石材料储氢容量的限制因素在于其骨架相对较大的质量,该结构包含了大量的Si、Al、O以及重的阳离子。另外,许多材料的空穴直径对于氢分子来说过大,对储氢不利。以上的事实表明,它们不太适合应用于氢气储存领域。然而,类似结构化合物的 研究 仍是一个热点,比如下文提到的MOF。
(3) 金属有机骨架化合物
金属有机骨架(Metal-Organic Framework, MOF)是一类有趣的化合物,它们在77K下有储氢能力,室温下可以在低于20bar条件下吸氢。这些材料是具金属节点、有机连接体骨架的晶体,拥有规则大小的空腔及内部结构。这项 研究 引起人们特别的兴趣,因为大多数由金属氧化物(沸石等)组成的微孔骨架结构材料的储氢能力都不佳。此物的出现让人们重新审视微孔骨架物质的潜力。材料MOF-5(图8左)在77K及温和压力下,有1.3 wt.%的吸氢能力,其中无机原子团[OZn4]6+靠原子团[O2C-C6H4-CO2]2-(对苯二甲酸根,BDC)互相连接形成多孔的立方骨架。在室温、20bar压力下它只吸收1 wt.%的氢气,但储氢容量随压力升高而增大。
MOF-5及相关化合物的结构样式对于气体吸附来说很理想,因为其中连接部分彼此独立,允许气体分子从任意方向进入。MOF-5及其衍生物的脚手架式的结构特点导致其具有极高的比表面(2500-3000 m2 g-1)。
由左至右分别为MOF-5, IRMOF-6, IRMOF-8
其它类似的结构中,IRMOF-6(以苯并环丁烷连接,上图中)和IRMOF-8(以萘连接,上图右)在室温、20bar压力下的载氢能力大约分别是MOF-5的两倍和四倍。室温下这些结构的储氢能力与低温下的碳纳米管相近。
在不同的MOF化合物中,无机的金属基团一般都是[OZn4]6+四面体,不同的只是连接各四面体的多元有机酸分子。用直线结构的二元羧酸(如对苯二甲酸)连接,可以得到立方体形状的空穴;如果用平面三角结构的三元羧酸,就可以得到八面体形状的空穴。不同连接体造成空穴的直径也不等。在较大的空穴中加入金属原子或C60等物质填充,可以引入不同的作用力,这对于储氢可能会有帮助。
MOF之间的结构差异基本上由连接体决定,于是人们只通过替换有机酸分子就可以随心所欲地生产出各种孔径的微孔材料,这对于优化微孔材料的储氢性能是一个莫大的便利。
第二节 发展历程
世界上最早发现的是金属钯,1体积钯能溶解几百体积的氢气,但钯很贵,缺少实用价值。20世纪70年代以后,由于对氢能源的 研究 和开发日趋重要,首先要解决氢气的安全贮存和运输问题,储氢材料范围日益扩展至过渡金属的合金。如镧镍金属间化合物就具有可逆吸收和释放氢气的性质:每克镧镍合金能贮存0.157升氢气,略为加热,就可以使氢气重新释放出来。LaNi5是镍基合金,铁基合金可用作储氢材料的有TiFe,每克TiFe能吸收贮存0.18升氢气。其他还有镁基合金,如Mg2Cu、Mg2Ni等,都较便宜。
免责申明:本文仅为中经纵横 市场 研究 观点,不代表其他任何投资依据或执行标准等相关行为。如有其他问题,敬请来电垂询:4008099707。特此说明。




